1. Sinopsis
Madison Mitchell, una mujer que sufre violencia doméstica, comienza a experimentar visiones aterradoras de asesinatos brutales justo después de un ataque por parte de su esposo. A medida que los crímenes se multiplican, Madison se da cuenta de que las escenas que presencia en sus visiones son reales.
 |
| Madison, la protagonista de Malignant |
A través de la investigación, se revela que Madison tuvo un gemelo parasitario llamado Gabriel, una entidad maligna unida a su cuerpo desde su nacimiento. Gabriel fue parcialmente extirpado en su infancia, pero una parte de él quedó latente en su cerebro. Debido a un trauma reciente, Gabriel "despierta" y comienza a controlar su cuerpo, cometiendo asesinatos como venganza hacia quienes participaron en la cirugía que intentó separarlos.
 |
| La verdad que no tiene desperdicio la película |
La película mezcla horror psicológico, gore y elementos sobrenaturales con una base muy libremente inspirada en el fenómeno médico real de los gemelos parasitarios. Gabriel se manifiesta físicamente cuando toma el control del cuerpo de Madison, deformando su cuerpo al "salir" por la parte posterior de su cráneo.
 |
| Aquí viene Gabriel |
2. Gemelos siameses: conectados desde el nacimiento
Los gemelos siameses son un fenómeno extremadamente raro en la naturaleza humana, que ocurre cuando dos bebés nacen físicamente unidos entre sí por alguna parte de su cuerpo. Este tipo de gemelación se conoce científicamente como gemelos unidos y representa una forma inusual de embarazo en la que ambos gemelos se encuentran dentro del mismo saco amniótico y comparten la misma placenta.
Biológicamente, los gemelos siameses se originan de la misma manera que los gemelos idénticos: a partir de un solo óvulo fecundado que se divide accidentalmente para formar dos embriones. Sin embargo, en el caso de los siameses, esta división ocurre de forma incompleta o tardía, generalmente después del día 13 de gestación. Como resultado, los embriones no se separan completamente y permanecen conectados en alguna parte del cuerpo: pecho, abdomen, cabeza, columna vertebral, entre otras.
 |
| ¿Por qué se dan los siameses? |
La ubicación y extensión de la unión depende del momento exacto y la forma en que se detuvo la separación. En algunos casos, los gemelos comparten órganos vitales, lo que puede dificultar gravemente la posibilidad de separación quirúrgica o afectar su viabilidad.
 |
| Los siameses Chang y Eng con dos de sus 21 hijos |
Este fenómeno ocurre en aproximadamente 1 de cada 50.000 a 200.000 nacimientos, y la tasa de supervivencia es baja: muchos fetos no sobreviven hasta el nacimiento o fallecen poco después. La operación quirúrgica es delicada e implica un elevado riesgo para los gemelos. No obstante, gracias a los avances médicos, cada vez hay más casos exitosos de separación y de gemelos siameses que llevan vidas plenas, incluso si permanecen unidos.
Este tema ya había sido tratado con anterioridad en el blog, en la entrada sobre la película "Pegado a ti" por lo que quiero darle otra vuelta de tuerca al tema y abordar el tema de los gemelos parásitos o heterópagos.
3. Dentro de tí. "Fetus in fetus"
Los gemelos heterópagos, también conocidos como gemelos parásitos, constituyen una variante extremadamente rara de los gemelos siameses. En estos casos, uno de los embriones (el gemelo "parásito") no se desarrolla completamente y nace adherido al cuerpo del otro gemelo (el gemelo "autónomo" o "hospedador"), que sí tiene una estructura funcional y viable.
 |
| gemelos heterópagos |
Desde el punto de vista biológico, los gemelos heterópagos se originan igual que los siameses: a partir de la división incompleta de un óvulo fecundado. Sin embargo, en este caso, la diferencia radica en que uno de los embriones deja de desarrollarse correctamente durante las primeras etapas del embarazo y termina dependiendo completamente del otro para sobrevivir.
El gemelo parásito suele carecer de órganos vitales, como cerebro o corazón, y puede presentarse como una masa de tejidos o estructuras anatómicas parciales (brazos, piernas, órganos rudimentarios) adheridas a distintas partes del cuerpo del gemelo hospedador, comúnmente en el abdomen, tórax o pelvis. En rarísimas ocasiones, el parásito se encuentra en el interior del cuerpo del gemelo hospedador, una condición conocida como fetus in fetu.
Los gemelos heterópagos se pueden dividir en tres tipos:
- Parásitos onfalópagos: Presentan un pequeño cuerpo colgando de la zona abdominal del huésped.
- Parásitos dípigos o pigomelia: Consiste en la duplicación de las extremidades inferiores. En los dípigos completos una pequeña pelvis pende sobre la normal y la persona ejerce control activo sobre sus cuatro piernas. En la mayoría de los casos presentan sin embargo piernas poco desarrolladas unidas a la pelvis única.
- Parásitos craniópagos: Presentan otra cabeza unida a la parte superior de la principal. El caso más antiguo y famoso conocido es el Niño con dos cabezas de Bengala.
 |
| Gemelos onfalópagos |
 |
| Gemelos dípigos |
 |
| Gemelos craniópagos |
La primera descripción confiable de gemelos unidos parásitos fue realizada en el siglo XVI por Ambroise Paré, cirujano francés que describió un cuerpo acéfalo unido al abdomen de uno de sus pacientes. Si la probabilidad de que en un nacimiento nazcan siameses es ya de por sí baja, la casualidad en este caso es muchísimo más extraña: un estudio europeo realizado sobre casi 5 millones de neonatos, encontró una prevalencia de 0.02 nacimientos por cada 100.000. De acuerdo a un artículo publicado en BBC News, solamente 40 a 50 casos de gemelos parásitos han sido documentados en la literatura médica mundial. Se desconoce con precisión su tasa de incidencia, aunque un estudio científico publicado en 2018 estima que afectan a menos de uno de cada millón de nacimientos en todo el planeta.
Esta excepcional circunstancia es posible visualizarla durante el embarazo gracias a una ecografía, aunque en algunos casos no se detecta hasta el el momento del nacimiento. El tratamiento habitual es quirúrgico y consiste en extirpar el tejido parásito, especialmente si representa un riesgo para la salud del gemelo hospedador. Es importante hacerlo puesto que el gemelo parásito aprovecha los nutrientes del hospedador para alimentar los órganos formados, y de esta forma supone un peligro para la supervivencia del individuo completo.
 |
| Escena de Desafío Final |
A pesar de la dificultad, algunas operaciones quirúrgicas, pese a lo delicadas que resultan son llevadas a cabo con éxito. En 2007, un equipo de cirujanos en la India llevó a cabo una compleja y delicada operación para separar a Lakshmi Tatma, una niña que nació con cuatro brazos y cuatro piernas debido a que su cuerpo absorbió parcialmente a un gemelo no desarrollado. La intervención, que duró más de 24 horas y requirió la participación de más de 30 médicos, consistió en remover los miembros adicionales y reconstruir partes esenciales de su cuerpo. Los cirujanos tuvieron que reconstruir el anillo pélvico de la pequeña, así como extirparle los brazos, las piernas y los riñones inservibles de su gemela parásita. La operación fue un éxito y marcó un hito médico, permitiendo que Lakshmi pudiera llevar una vida más funcional y saludable.
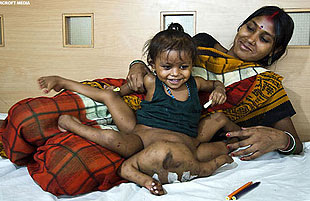 |
| Lakshmi |
- "Yo nunca pedí estar pegado a ti"
Gabriel a Madison en Malignant



























